Régóta ismert, hogy minden molekula két azonos és ellentétes töltéssel rendelkezik, amelyeket egy bizonyos távolság választ el egymástól. Ilyen poláris molekulák esetén a negatív töltés középpontja nem esik egybe a pozitív töltés középpontjával. Az ilyen kovalens molekulákban a polaritás mértékét a Dipole Moment kifejezéssel írhatjuk le, amely lényegében a poláris kovalens kötés polaritásának mértéke.
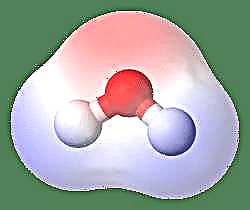
A dipól legegyszerűbb példája a vízmolekula. A vízmolekula poláris, mivel elektronjainak egyenlőtlen megoszlása van egy „hajlított” szerkezetben. A vízmolekula szöget alkot, hidrogénatomokkal a csúcsokon és oxigénatomokkal a csúcson. Mivel az oxigénnek nagyobb elektronegativitása van, mint a hidrogénnek, a molekula oldala és az oxigénatom részleges negatív töltéssel rendelkezik, míg a hidrogén közepén részleges pozitív töltéssel rendelkezik. Emiatt a dipól-nyomaték iránya az oxigén felé mutat.
A fizika nyelvén az elektromos dipólmomentum a pozitív és negatív elektromos töltések szétválasztásának mértéke egy töltési rendszerben, vagyis a töltési rendszer teljes polaritásának - azaz a molekulák elektromos töltésének szétválasztásának - mértéke, amely egy dipólushoz vezet. Matematikailag és két pont töltés esetén, egy + q töltéssel és egy, q töltéssel, a p elektromos dipól-pillanat kifejezhető: p = qd, ahol d a negatív töltéstől a a pozitív töltés. Így az elektromos dipól momentumvektor a negatív töltésről a pozitív töltésre mutat.
Egy másik módszer erre a módszerre, ha a dipól pillanatot ábrázolja m, m = ed görög betűvel, ahol e az elektromos töltés és d az elválasztási távolság. Ezt a Debye egységben fejezik ki, és D-vel írják (ahol 1 Debye = 1 x 10-18e.s.u cm). A dipólmomentum vektormennyiség, ezért egy kis nyíl jelzi, amelynek farka a pozitív középpontban és a fej negatív központ felé mutat. Vízmolekula esetében a dipólusideje 1,85 D, míg a sósavmolekula 1,03 D, és a következőképpen reprezentálható:
Sok cikket írtunk a dipólus pillanatáról a Space Magazine számára. Itt található egy cikk arról, hogy miből készül a víz, és ez egy cikk a molekulákról.
Ha további információt szeretne a dipólus pillanatáról, olvassa el ezeket a cikkeket a Hyperphysics and Science Daily oldalból.
A csillagászat teljes epizódját felvettük az űrben levő molekulákról is. Hallgassa meg itt, 116. epizód: Molekulák az űrben.
Forrás:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule