Az idők kezdete óta az emberek arra törekedtek, hogy megértsék, miből áll az univerzum és a benne lévő minden. És miközben az ősi mágusok és filozófusok négy vagy öt elemből - földből, levegőből, vízből, tűzből (és fémből, vagy tudatosságból) álló világot gondoltak fel - a klasszikus antikvitás során a filozófusok elméletbe állították, hogy az anyag valójában apró, láthatatlan és oszthatatlan atomok.
Azóta a tudósok folyamatban vannak az atommal való felfedezés folyamatában, remélve, hogy felfedezik annak valódi természetét és felépítését. A 20. századra megértésünk olyan pontossá vált, hogy pontos modellt tudtunk felépíteni. És az elmúlt évtizedben a megértésünk még tovább haladt arra a pontra, hogy megerősítettük majdnem annak minden elméleti részét.
Manapság az atomkutatás az anyag felépítésének és funkciójának szubatómiai szintű tanulmányozására összpontosít. Ez nem csupán az összes szubatomi részecske azonosításából áll, amelyekről azt gondolják, hogy atomot alkotnak, hanem az őket irányító erők vizsgálatáról is. Ide tartoznak az erős nukleáris erők, a gyenge nukleáris erők, az elektromágnesesség és a gravitáció. Itt van az összes bontás, amelyet eddig az atomról megtudtunk.
Az atom felépítése:
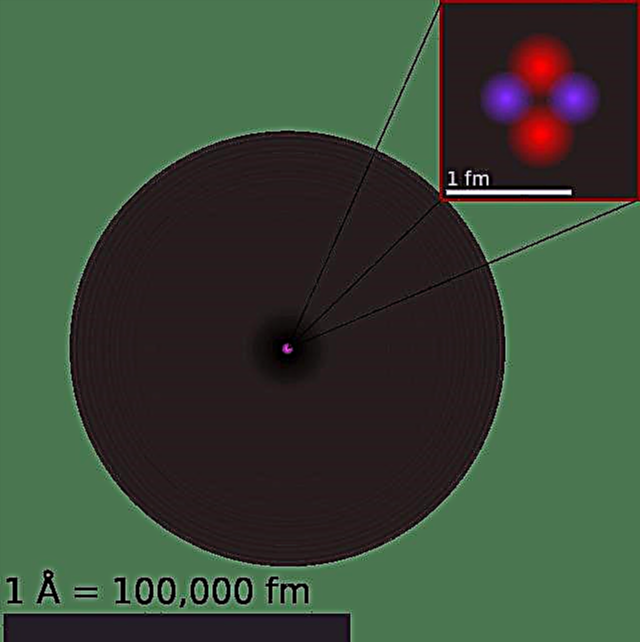
Az atom jelenlegi modelljét három alkotóelemre bonthatjuk - protonokra, neutronokra és elektronokra. Ezeknek a részeknek egy-egy töltése van, pozitív töltéssel rendelkező protonokkal, negatív töltéssel rendelkező elektronokkal és nettó töltés nélküli neutronokkal. A részecskefizika standard modelljével összhangban a protonok és a neutronok alkotják az atommagját, miközben az elektronok „felhőben” keringik.

Egy atom elektronjai az atommagban levő protonokhoz az elektromágneses erő hatására vonzódnak. Az elektronok kikerülhetnek pályájukról, de csak egy külső energiaforrás hatására. Minél közelebb áll az elektron pályája a maghoz, annál nagyobb a vonzó erő; ennélfogva annál erősebb a külső erő, amely ahhoz szükséges, hogy egy elektron elmeneküljön.
Az atomok a keringő elektronok több pályán keringnek, amelyek mindegyike megfelel az elektron adott energiaszintjének. Az elektron megváltoztathatja állapotát magasabb energiaszintre, ha elegendő energiájú fotont vesz fel, hogy felvegye az új kvantumállapotba. Hasonlóképpen, egy magasabb energiaállapotú elektron alacsonyabb energiaállapotba is eshet, miközben a fölösleges energiát fotonként sugározza.
Az atomok elektromos szempontból semlegesek, ha azonos számú protonnal és elektronmal rendelkeznek. Azokat az atomokat, amelyeknek hiánya vagy elektronfeleslege van, ionoknak nevezzük. A magtól legtávolabb eső elektronok átvihetők más közeli atomokba vagy megoszthatók az atomok között. E mechanizmus révén az atomok képesek molekulákhoz és más típusú kémiai vegyületekhez kötődni.
E szubatomikus részecskék mindhárom része Fermion, az anyaggal társított részecskeosztály, amely vagy elemi (elektronok), vagy kompozit (protonok és neutronok) természetű. Ez azt jelenti, hogy az elektronoknak nem ismert belső szerkezete, míg a protonok és a neutronok más szubatomi részecskékből állnak. kvarknak hívják. Kétféle kvark létezik az atomokban, amelyek frakcionált elektromos töltésűek.

A protonok két „fel” kvarkból (mindegyik +2/3 töltéssel) és egy „le” kvarkból (-1/3) állnak, míg a neutronok egy fel és kettõ kvarkból állnak. Ez a megkülönböztetés a két részecske közötti töltéskülönbségből adódik, amely +1 és 0 töltésre képes, míg az elektronok töltése -1.
Más szubatómiai részecskék közé tartoznak a Leptonok, amelyek a Fermionokkal kombinálódnak, hogy az anyag építőelemeit képezzék. A jelen atommodellben hat lepton található: az elektron, a muon és a tau részecskék, valamint a hozzájuk kapcsolódó neutrinók. A Lepton-részecskék különböző fajtáit, amelyeket általában ízeknek hívnak, méretük és töltéseik alapján különbözik egymástól, ami befolyásolja elektromágneses kölcsönhatásaik szintjét.
Aztán vannak olyan Gauge Bosonok, amelyeket „erőhordozóknak” hívnak, mivel a fizikai erőket közvetítik. Például a gluonok felelősek az erőteljes nukleáris erőért, amely a kvarcokat tartja össze, míg a W és Z (továbbra is hipotetikus) boszonok felelősek az elektromágnesesség miatti gyenge nukleáris erőért. A fotonok az az elemi részecske, amelyek fényt alkotnak, míg a Higgs Boson felelõs a tömeg megadásáért a W és a Z boszonokért.
Atomtömeg:
Az atomtömeg nagy része a protonokból és a neutronokból származik, amelyek alkotják a magját. Az atomok alkotó részecskéinek elektronjai a legkevésbé masszák, tömegük 9,11 x 10-31 kg és a méret túl kicsi ahhoz, hogy a jelenlegi technikákkal meg lehessen mérni. A protonok tömege 1836-szorosa az elektron tömegének, 1,6726 × 10-nél-27 kg, míg a neutronok a legtömegebbek a három közül, 1,6929 × 10-nél-27 kg (az elektron tömegének 1839-szerese).

Az atommagban lévő protonok és neutronok teljes számát (úgynevezett „nukleonoknak”) tömegszámnak nevezzük. Például a Carbon-12 elemet úgynevezik, mert tömegszáma 12 - származik 12 nukleonjából (hat proton és hat neutron). Az elemeket ugyanakkor atomszámuk alapján rendezik el, ami megegyezik a magban található protonok számával. Ebben az esetben a szén atomszáma 6.
Az ató tényleges tömegét nyugalmi helyzetben nagyon nehéz megmérni, mivel még a legtökéletesebb atomok is túl könnyűek ahhoz, hogy kifejezzék a hagyományos egységeket. Mint ilyen, a tudósok gyakran az (u) egységesített atomtömeg-egységet - más néven dalton (Da) - használják, amelyet a szabad semleges szén-12 tömegének tizenketted részének tekintik, amely megközelítőleg 1,66 × 10-27 kg.
A kémikusok anyajegyeket is használnak, azaz egy elem, amelyet bármely elem egy moljának definiálnak, mindig azonos számú atommal (kb. 6,022 × 1023). Ezt a számot úgy választották meg, hogy ha egy elem atomtömege 1 u, akkor egy elem atomjának tömege megközelíti egy grammot. Az egységes atomtömeg-egység meghatározása miatt minden szén-12 atom atomtömege pontosan 12 u, tehát egy mól szén-12 atom súlya pontosan 0,012 kg.
Radioaktív bomlás:
Bármely olyan atom, amely azonos számú protonnal rendelkezik, ugyanabba a kémiai elembe tartozik. De az azonos számú protonokkal rendelkező atomok eltérő számú neutronnal rendelkezhetnek, amelyeket ugyanazon elem különböző izotópjaiként definiálnak. Ezek az izotópok gyakran instabilok, és ismertek radioaktívnak mindazokról, amelyeknek a atomszáma meghaladja a 82-et.
Amikor egy elem lebomlik, a magja veszít energiát sugárzás kibocsátásával - amely alfa részecskékből (hélium atomok), béta részecskékből (pozitronok), gammasugarakból (nagyfrekvenciás elektromágneses energia) és konverziós elektronokból állhat. Az instabil elem bomlási sebességét úgy nevezzük, mint annak „felezési ideje”, amely az az idő, amely ahhoz szükséges, hogy az elem az eredeti érték felére esjen.
Az izotóp stabilitását befolyásolja a protonok és a neutronok aránya. A 339 különféle típusú elem közül, amelyek természetesen előfordulnak a Földön, 254-et (kb. 75%) „stabil izotópokként” jelöltek - azaz nem bomlanak. További 34 radioaktív elem felezési ideje meghaladja a 80 millió évet, és a korai Naprendszer óta is léteznek (ezért nevezik őket „elsődleges elemeknek”).
Végül, további 51 rövid élettartamú elemről ismert, hogy természetes úton fordul elő, mint „leányelemek” (azaz nukleáris melléktermékek) más elemek (például uránium rádium) bomlásában. Ezenkívül a rövid élettartamú radioaktív elemek a Földön zajló természetes energetikai folyamatok, például kozmikus sugárbombázás eredményei lehetnek (például a légkörünkben előforduló szén-14).
A tanulmány története:
Az atomelmélet legkorábbi ismert példái az ókori Görögországból és Indiából származnak, ahol a filozófusok, mint például a Democritus azt állította, hogy az anyag apró, oszthatatlan és elpusztíthatatlan egységekből áll. Az „atom” kifejezést az ókori Görögországban hozták létre, és az „atomizmus” néven működő gondolkodási iskolába vezetett. Ez az elmélet azonban inkább filozófiai, mint tudományos koncepció volt.
Az atomok elméletét csak a 19. században tudományos kérdésként fogalmazták meg, amikor elvégezték az első bizonyítékokon alapuló kísérleteket. Például az 1800-as évek elején John Dalton angol tudós az atom fogalmát magyarázta azzal, hogy a kémiai elemek miért reagálnak bizonyos megfigyelhető és kiszámítható módon.
Dalton azzal a kérdéssel kezdett, hogy az elemek miért reagálnak kis egész számok arányában, és arra a következtetésre jutott, hogy ezek a reakciók különálló egységek egész számának többszöröseiben, vagyis az atomokban fordulnak elő. Gázokkal kapcsolatos kísérletek sorozatán keresztül Dalton tovább dolgozta ki a Dalton Atomic Theory néven ismertt, amely továbbra is a modern fizika és kémia sarokköve.
Az elmélet öt feltevésből áll: az elemek a legtisztább állapotban atomoknak nevezett részecskékből állnak; egy adott elem atomjai azonosak, a legelső atomig; a különféle elemek atomjai az atomtömegük alapján megkülönböztethetők; az elemek atomjai vegyi vegyületeket képeznek; az atomok nem hozhatók létre vagy sem pusztulhatnak el kémiai reakcióban, csak a csoportok változnak meg.
A 19. század végére a tudósok elméletük szerint elkezdték állítani, hogy az atom egynél több alapegységbõl áll. A legtöbb tudós azonban úgy vélte, hogy ez az egység a legkisebb ismert atom méretű - hidrogén. Aztán 1897-ben katódos sugarak felhasználásával végzett kísérletek sorozatán keresztül a J.J. Thompson bejelentette, hogy felfedezett egy egységet, amely 1000-szer kisebb és 1800-szor könnyebb, mint a hidrogénatom.

Kísérletei azt is kimutatták, hogy azonosak voltak a fotoelektromos hatás és a radioaktív anyagok által kibocsátott részecskékkel. A későbbi kísérletek azt mutatták, hogy ez a részecske elektromos áramot szállított fém huzalokon keresztül és negatív elektromos töltéseket az atomokon belül. Ezért a részecskét - amelyet eredetileg „corpuscle” -nek neveztek - később „elektronra” váltották, miután a részecske George Johnstone Stoney 1874-ben megjósolta.
Thomson azonban azt is állította, hogy az elektronok az atom egészében eloszlanak, amely egységes pozitív töltésű tenger volt. Ez a „szilva puding modell” néven vált ismertté, amely később tévesnek bizonyul. Erre 1909-ben került sor, amikor a fizikusok, Hans Gieger és Ernest Marsden (Ernest Rutherfod irányítása alatt) fémfóliával és alfa-részecskékkel végezték kísérletüket.
A Dalton atommodelljével összhangban azt hitték, hogy az alfa-részecskék egyenesen áthaladnak a fólián kevés alakváltozással. Ugyanakkor sok részecske 90 ° -nál nagyobb szöget hajtott végre. Ennek magyarázata érdekében Rutherford javasolta, hogy az atom pozitív töltése a középpontban lévő apró magba koncentrálódjon.
1913-ban Niels Bohr fizikus olyan modellt javasolt, amelyben az elektronok keringtek a magban, de csak egy véges körpályán képesek voltak megtenni. Azt is javasolta, hogy az elektronok ugrálhassanak a keringési körök között, de csak az energia diszkrét változásaiban, amelyek megfelelnek a foton abszorpciójának vagy sugárzásának. Ez nemcsak finomította a Rutherford által javasolt modellt, hanem egy kvantált atom fogalmához vezetett, ahol az anyag diszkrét csomagokban viselkedett.

A tömegspektrométer kifejlesztése - amely mágnest használ az ionsugár pályájának meghajlításához - lehetővé tette az atomtömeg nagyobb pontosságú mérését. Francis William Aston kémikus ezt az eszközt használta annak bemutatására, hogy az izotópok különböző tömegűek. Ezt viszont James Chadwick fizikus követte, aki 1932-ben javaslatot tett a neutronra az izotópok létezésének magyarázatának egyik módjaként.
A 20. század elején az atomok kvantum jellegét tovább fejlesztették. 1922-ben a német fizikusok, Otto Stern és Walther Gerlach kísérletet végeztek, amelynek során ezüst atomok sugárát egy mágneses mezőn keresztül irányították, amelynek célja a sugár megosztása az atomok szögmozgása (vagy spinje) iránya között.
Stern – Gerlach kísérlet néven az eredmények azt mutatták, hogy a sugár két részre oszlik, attól függően, hogy az atomok spinje felfelé vagy lefelé volt-e irányítva. 1926-ban Erwin Schrodinger fizikus a hullámként viselkedő részecskék gondolatát felhasználva kidolgozta egy olyan matematikai modellt, amely az elektronokat puszta részecskék helyett háromdimenziós hullámformákként jellemezte.
A hullámformáknak a részecskék leírására történő felhasználásának következménye az, hogy matematikailag lehetetlen pontos értékeket elérni a részecske helyzetére és lendületére egy adott időpontban. Ugyanebben az évben Werner Heisenberg megfogalmazta ezt a problémát, és „bizonytalanság elvének” nevezte. Heisenberg szerint egy adott pontos helyzetméréshez csak a várható impulzusértékek egy sorát lehet megszerezni, és fordítva.

Az 1930-as években a fizikusok felfedezték a maghasadást Otto Hahn, Lise Meitner és Otto Frisch kísérleteinek köszönhetően. Hahn kísérletei során a neutronokat urán-atomokra irányították, a transzurán elem létrehozásának reményében. Ehelyett a folyamat az urán-92 mintáját (Ur92) két új elemré - báriumba (B56) és kripton (Kr27).
Meitner és Frisch igazolta a kísérletet, és az uránatomoknak osztva azt tulajdonította, hogy két elem alakuljon ki azonos atomtömeggel. Ez az eljárás szintén jelentős mennyiségű energiát bocsát ki az atomkötések megbontásával. Az ezt követő években megkezdődött a folyamat lehetséges fegyverzetének kutatása (azaz nukleáris fegyverek), és 1945-ig az Egyesült Államokban első atombombák készítéséhez vezettek.
Az 1950-es években a továbbfejlesztett részecskegyorsítók és részecskedetektorok kifejlesztése lehetővé tette a tudósok számára, hogy megvizsgálják a nagy energiájú mozgó atomok hatásait. Ebből a részecskefizika standard modelljét fejlesztették ki, amely eddig sikeresen elmagyarázta a mag tulajdonságait, az elméletben szereplő szubatomi részecskék meglétét és az egymással való kölcsönhatásukat szabályozó erőket.
Modern kísérletek:
A 20. század második fele óta számos új és izgalmas felfedezés történt az atomelmélet és a kvantummechanika területén. Például 2012-ben a Higgs Boson hosszú keresése áttörést eredményezett, ahol a svájci Európai Nukleáris Kutatási Szervezetnél (CERN) dolgozó kutatók bejelentették felfedezését.

Az elmúlt évtizedekben a fizikusok sok időt és energiát fordítottak egy egységesített teoretikus elmélet (más néven: Grand egyesítő elmélet vagy minden elmélete) kifejlesztésére. Lényegében a standard modell előterjesztése óta a tudósok megpróbálták megérteni, hogy az univerzum négy alapvető ereje (gravitáció, erős és gyenge nukleáris erők és elektromágnesesség) működnek együtt.
Míg a gravitáció Einstein relativitáselmélete alapján érthető meg, míg a nukleáris erők és az elektromágnesesség kvantumelmélettel értelmezhetők, egyik elmélet sem tudhatja meg, hogy mind a négy erő együtt működik. Ennek megoldására tett kísérletek számos javasolt elmélethez vezettek az évek során, kezdve a Húr-elmélettől a Hurok-kvantum gravitációig. A mai napig ezen elméletek egyike sem vezet áttöréshez.
Az atom megértése hosszú utat tett meg, a klasszikus modellektől kezdve, amelyek közömbös szilárd anyagnak tekintik azt, amely más atomokkal mechanikusan kölcsönhatásba lép, a modern elméletekig, ahol az atomok energetikai részecskékből állnak, amelyek kiszámíthatatlanul viselkednek. Noha több ezer év telt el, minden anyag alapvető szerkezetének ismerete jelentősen fejlődött.
És még mindig sok rejtély van, amelyeket még meg kell oldani. Idővel és a folyamatos erőfeszítésekkel végre felszabadíthatjuk az atom utolsó titkait. Ugyanakkor, valószínűleg az is, hogy az új felfedezések csak további kérdéseket vetnek fel - és még ennél is zavaróbbak lehetnek, mint az előbbiek!
Számos cikket írtunk az atomról a Space Magazine számára. Íme egy cikk a John Dalton atommodelljéről, Neils Bohr atommodelljéről, ki volt Demokrata ?, és hány atom van az univerzumban?
Ha további információt szeretne az atomról, olvassa el a NASA cikkét az apró minták elemzéséről, és itt található egy link a NASA atomokról, elemekről és izotópokról szóló cikkében.
A csillagászat teljes epizódját felvettük az Atomról is. Hallgassa meg itt: 164. epizód: Az Atom belsejében, 263. epizód: Radioaktív pusztulás és 394. epizód: A standard modell, Bosonok.